團結香港基金發表《凝聚政產學研力量 建設臨床研究之都》政策倡議報告
團結香港基金
發表《凝聚政產學研力量 建設臨床研究之都》政策倡議報告
【2023年11月30日,香港】團結香港基金發表新一份題為《凝聚政產學研力量 建設臨床研究之都》的政策倡議報告,香港科技園公司為是次報告的策略夥伴。報告強調,臨床研究是生物科技價值鏈之中的關鍵一環,不但能彌合香港卓越的學術研究與藥物商業化之間的鴻溝,更能吸引製藥公司入駐新藥研發基地,最終讓患者從最新的臨床創新突破中獲益。由英國國家健康與保健研究所的經驗可見,針對臨床試驗的投資可產生高達7.6倍的經濟效益,足以顯示其經濟發展潛力。
香港有兩所大學在醫學領域排名全球前五十,在藥劑及藥理學則排名前一百。另外,香港的世界級醫療服務和試驗質量廣受認可,以上優勢都為發展香港成為全球生物科技樞紐創造了最佳的條件。政府已於去年發布的《香港創新科技發展藍圖》中,將生命健康科技定為重點發展領域。在國家「十四五」規劃中,生物科技亦被列為戰略性新興產業。
事實上,生物科技發展已經成為全球趨勢。未來十年,全球的臨床研究試驗預計將以每年6%的速度快速增長,而亞洲將成為其中主要引擎。然而,香港的臨床試驗數目在2015至2021年間卻下降了22%,與主要經濟體平均48%的增長,乃至中國內地285%的爆發式增長形成鮮明對比。
為找出香港競爭力滯後的原因,本研究透過對約250位專家學者進行深度訪談及問卷調查,揭示了香港臨床研究主要面臨的三方面挑戰。
首先,臨床研究者及研究輔助人員缺乏支持。七成受訪者認為研究者數量不足是因為醫院醫生的工作超出負荷,加上行政程序繁複、加班工作不獲認可,令他們望而卻步。其二,相對於周邊的經濟體,香港批核臨床試驗及簽訂合同的流程過長且累贅。就第一期首次人體臨床試驗而言,九成受訪者指出臨床試驗證書批核需時超過三個月,導致製藥公司因商業考慮難以選擇香港作為試驗基地。其三,香港並無進行第一層藥物審查的能力,即審查臨床試驗數據以批准藥物註冊的能力。對於製藥公司而言,藥物需先經過外地審批再來港進行第二層審查,嚴重降低了他們在香港進行臨床試驗的意願。
為解決以上難題,本報告提出五項政策建議,透過招商引資、培養人才,增強香港作為中西橋樑的地位,從而將香港建設為臨床研究及藥品商業化的首選地。其中重點包括成立臨床研究所推動政策落實,以及設立香港獨立的藥物第一層審查機構。
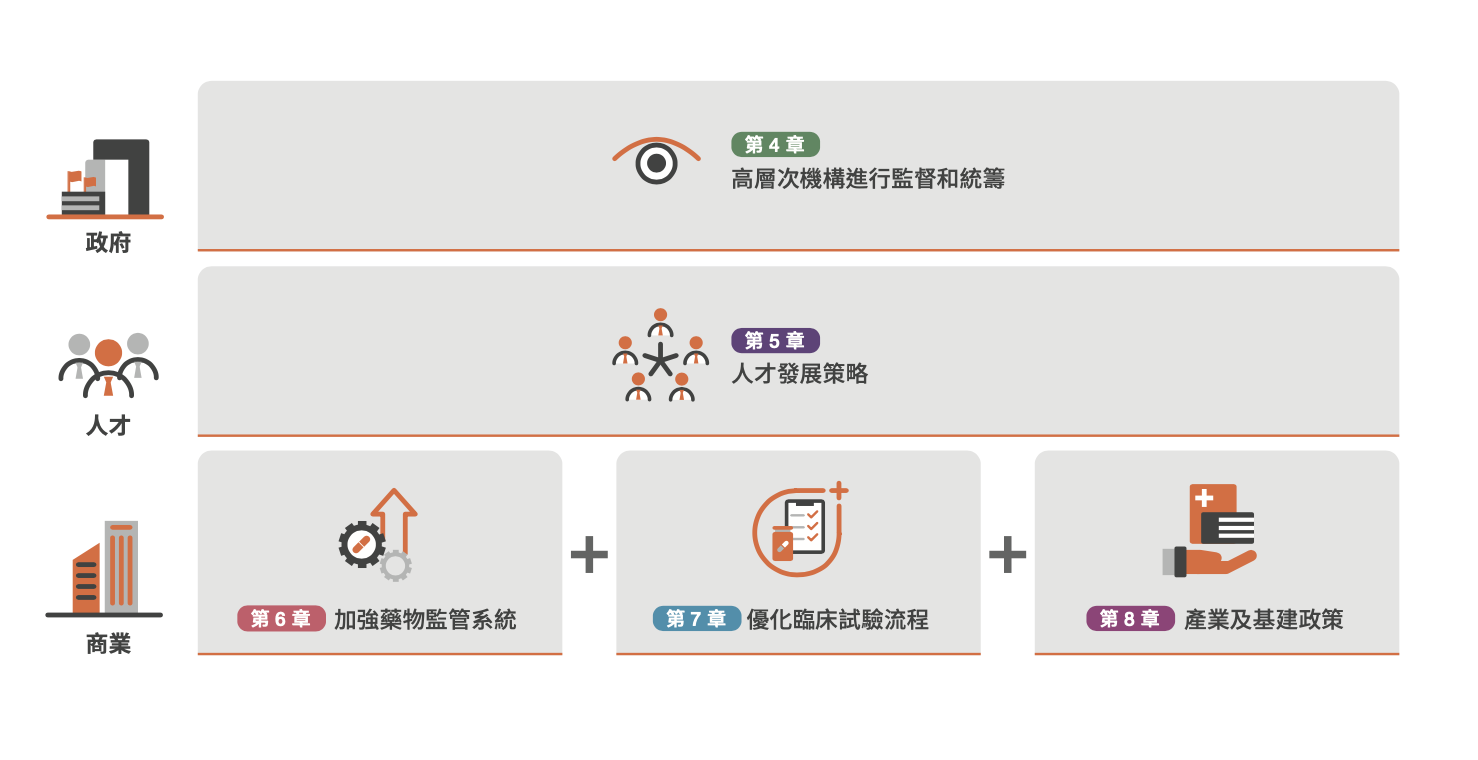
建議一:由醫務衞生局策略性規劃臨床研究發展
政府應加強其推動臨床研究的角色,在醫務衞生局轄下設立臨床研究所。參考英國國家健康與保健研究所的架構,該研究所可負責協調大學、醫院管理局(醫管局)及私營機構,並擴大目前研究辦公室的職權範圍,為臨床創新提供關鍵的人手和資源。
此臨床研究所應發揮三大作用,即:
- 臨床研究服務中心應作為製藥公司、醫院和其他機構的一站式服務中心,提供可行性評估及病人轉介、研究中心管理、行政支援,以及放射及實驗室服務,並針對為目前沒有臨床試驗中心的非教學醫院提供支援。
- 臨床研究網絡應匯聚全球研究者,促進合作和交流。政府於2023年《施政報告》提議成立的「大灣區國際臨床試驗所」有助擴大網絡的覆蓋範圍。該網絡同時可以成為年輕專家籌集資金和獲得指導的平台。
- 臨床研究學院應提供專業培訓和認證,培養包括臨床研究協調員在內的臨床研究人才。
建議二:制定臨床研究人才發展策略
政府需要制定全面的人才發展策略,為研究者、研究協調員、研究護士和其他輔助人員建立職業發展路徑;一方面需要培養年輕人才,另一方面也需要更好地釋放現職人員的潛力。顧及到目前的人力資源挑戰,應進一步在醫管局內鼓勵臨床研究活動:
- 將臨床研究活動納入晉升的考慮因素,為參與臨床研究的醫生提供加班補貼,並以更靈活的安排,允許從申辦者所得的部分資金用於臨床研究發展;
- 透過創新模式,如開設臨床醫學科學家職位和擴展臨床研究獎助金,讓醫生能在工作中同時進行臨床服務及研究;
- 提供更多專業培訓機會,系統性地培訓臨床研究專才;同時,高等教育及專科培訓中應加入更多研究元素及課程。
建議三:將香港定位為藥物研發的「超級聯繫人」
本報告建議政府設立如同美國食品藥物管理局(FDA)、歐洲藥品管理局(EMA)及中國國家藥品監督管理局(國家藥監局)般的藥物第一層審查機構。政府在2023年《施政報告》提出成立「香港藥物及醫療器械監督管理中心」籌備辦公室,並已經以觀察員身分成功加入「國際醫藥法規協調會議」。此舉至關重要,為進一步促進藥物商業化,提供從實驗室研發到臨床使用的清晰路徑,完善由學術界、商界, 以及監管機構共同組成的人才生態圈,政府亦應:
- 邀請全球藥物監管專家擔任顧問和全職人員,以逐步增強審批不同類型藥物的能力(拓寬政府在2023年《施政報告》中「1+」機制的新藥適用範圍);
- 成為人用藥品註冊技術要求國際協調理事會(ICH)的成員,並參加國際間就藥物審批的多邊協議;
- 與國家藥監局合作,互相提供藥品註冊的簡略審查路徑並互認臨床試驗審批結果;以及
- 推動其他跨境合作措施,例如跨境科研資助計劃及便利生物樣本和生物化學材料流動。
雖然實現以上願景或需近8年之久,但藥物簡略審查預期可在2026年前達成。
建議四:縮短試驗啟動時間並提升試驗能力
省卻累贅的監管流程將有效提高臨床研究及發展的效率,從而提升香港的商業吸引力。具體措施包括:
- 推動倫理委員會互相認可審批結果;
- 參考澳洲、新加坡及台灣的做法,允許低風險研究項目在獲得倫理委員會審批後不需再由監管機構重新審批;
- 優化醫管局病人數據庫以符合國際標準,並參考韓國國家臨床試驗企業(KoNECT),開發數據存取權以促進病人轉介、研究中心監測,以及數據審計。
建議五:引進臨床試驗基建及技能
提供稅收及土地優惠以吸引中央實驗室及小型生產設施來港,提供關鍵的基礎設施及專業知識,令生態系統趨於完整。政府可善用2023年《施政報告》提及的「新型工業加速計劃」,考慮以吸引合同研發生產機構(CDMOs)為目標,以引進產品創新的專業知識並促進人才發展。
臨床研究是香港未來重要的增長引擎;不過要實現此願景, 需要應對來自政府、人才及商業方面的挑戰。在區域競爭者爭相推動生物科技發展的背景下,香港絕不能因過去的成就而自滿;政府必須與社會各界共同努力,增強香港的臨床研究能力、吸引力及國際聯繫,從而把香港打造成亞洲領先的臨床創新樞紐。
中國國際經濟交流中心常務副理事長、原國家食品藥品監督管理總局局長畢井泉在視像致辭中指出,生物醫藥已經成為中國建設創新型國家的重要標誌。他表示,「香港要進一步發揮國際化優勢,加強與大型跨國公司的合作,完善香港藥品監督管理制度,善用粵港澳大灣區發展機遇,統籌跨境多中心臨床實驗,努力把香港打造成國際化的生物醫藥創新中心。」
團結香港基金理事楊紹信博士在開幕致辭中說到:「創新的臨床研究是香港未來發展的重要增長引擎。首先,臨床研究是香港優良的學術及研究成果和創新醫藥及治療商業化之間的橋樑。最新公布的《施政報告》正帶領着香港朝向正確的方向邁進,包括即將成立的『香港藥物及醫療器械監督管理中心』籌備辦公室,並以觀察員身分加入國際醫藥法規協調會議。」
團結香港基金總裁李正儀博士指出:「香港應充分利用在港的知名科研機構,成為臨床創新樞紐。這不僅能推動經濟增長,加強香港作為創新藥物門戶的角色,更能讓病患獲得最新研發的藥物,提高醫療護理水平。因此,政府需通過全面的政策規劃以培養獨立審批藥物的能力,加強國際聯繫及推動人才發展。」
討論環節由香港特別行政區政府特首政策組組長黃元山博士主持,一眾學者及專家,包括:葛蘭素史克有限公司香港及澳門副總裁及總經理 Raj Bhatti;香港大學內科學系傳染病科主任孔繁毅教授;香港立法會議員、希瑪眼科醫療控股有限公司董事會主席及行政總裁林順潮醫生;醫院管理局總監(質素及安全) 黃立己醫生;香港科技園公司轉化研發所高級總監劉思雅博士;團結香港基金副總裁兼研究部聯席主管水志偉先生,就香港未來的臨床研究發展及培養醫生具備研究思維等方面交換意見。
《凝聚政產學研力量 建設臨床研究之都》政策倡議報告
中文版: 按此
















